公司新闻
亿胜生物公布2021年中期业绩
2021.08.12
下载查看
· 收入同比增长127.7%至7.37亿港元
· 净利润同比增长229.7%至1.62亿港元
香港,2021年8月12日
亿胜生物科技有限公司(“亿胜生物”或“集团”,股份代码:1061.HK)今日公布了截至2021年6月30日的中期财务业绩。
财务业绩
截至2021年6月30日止六个月,集团实现整体收入约7.37亿港元,较去年同期增长127.7%,受此提振,集团实现税后净利润约为1.62亿港元,相较去年同期0.49亿港元增长229.7%。
2021年中期收入及净利润,较 2019 年同期分别增长 26.8% 及 25.2%,表明集团已强劲恢复到新冠疫情之前的发展趋势。
目前集团的收入主要来源于两大业务板块:眼科及外科(创伤修复)。主要驱动现阶段收入增长的产品如下:
· 净利润同比增长229.7%至1.62亿港元
香港,2021年8月12日
亿胜生物科技有限公司(“亿胜生物”或“集团”,股份代码:1061.HK)今日公布了截至2021年6月30日的中期财务业绩。
财务业绩
截至2021年6月30日止六个月,集团实现整体收入约7.37亿港元,较去年同期增长127.7%,受此提振,集团实现税后净利润约为1.62亿港元,相较去年同期0.49亿港元增长229.7%。
2021年中期收入及净利润,较 2019 年同期分别增长 26.8% 及 25.2%,表明集团已强劲恢复到新冠疫情之前的发展趋势。
目前集团的收入主要来源于两大业务板块:眼科及外科(创伤修复)。主要驱动现阶段收入增长的产品如下:
- 眼科:贝复舒系列(贝复舒滴眼液、贝复舒眼用凝胶、贝复舒单剂量滴眼液),妥布霉素滴眼液、左氧氟沙星滴眼液、玻璃酸钠滴眼液、适利达®滴眼液、适利加®滴眼液以及适丽顺®(卵磷脂络合碘胶囊);
- 外科(创伤修复):贝复济系列(贝复济喷雾、贝复济冻干粉以及贝复新凝胶),T-Bactum®(抗菌口腔护理产品),伢典®龋齿微创祛腐凝胶及伊血安颗粒。
回顾期内,眼科及外科创收比例分别为39.9%及60.1%。集团核心生物药贝复舒及贝复济系列(以生长因子bFGF为活性药物成分)贡献收入比例约为86.4%,其中贝复舒及贝复济系列分别贡献27.0%及59.4%。另外的13.6%则主要由其他系列产品所贡献,主要包括妥布霉素滴眼液、左氧氟沙星滴眼液、玻璃酸钠滴眼液、适利达®滴眼液、适利加®滴眼液、适丽顺®(卵磷脂络合碘胶囊)、T-Bactum®以及伊血安颗粒。
回顾期内,得益于中国的医院恢复正常运营,集团眼科产品销售收入同比增长101.4%至约2.94亿港元;外科(创伤修复)产品销售收入同比增长149.4%至约4.43亿港元。
截至2021年6月30日总研发开支(包括收购无形资产)约为0.86亿港元,其中约0.75亿港元费用资本化(2020年同期约为0.48亿港元,其中约0.45亿港元费用资本化),这将进一步充实集团在研管线及加强内部研发能力。
截至2021年6月30日,集团现金及现金等价物约为6.58亿港元(截至2020年12月31日约为6.00亿港元)。
业务拓展关键进展
集团一直以来致力于结合实际发展诉求,投入新产品及前沿技术开发,以持续充实产品组合及在研管线。在加强在眼科领域的中短期增长引擎的同时,集团持续开发肿瘤领域新型疗法以支持长期发展。在眼科领域的业务拓展情况主要如下所述:
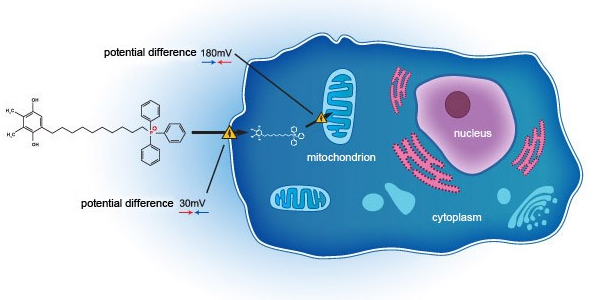
2018年,集团与Mitotech S.A.及Mitotech LLC就用于治疗干眼症的SkQ1滴眼液美国FDA三期临床试验达成一项共同开发协议。正如集团于2021年2月24日公告所示,三期临床第二阶段试验(VISTA-2)取得积极结果。本次临床试验在预设关键次要体征指标(中央角膜荧光素染色)显示了具有统计学意义的显著改善,与三期临床第一阶段试验(VISTA-1)结果一致。集团董事会对于本次试验数据中显示的中央角膜染色清除(即中央角膜零染色)表示振奋,因其揭示了SkQ1在解决干眼症中的氧化应激方面的潜力,同时也相当期待第三阶段临床试验(VISTA-3)的数据结果,按目前计划Mitotech目标于2022至2023年向美国FDA提交新药申请(NDA)。
根据弗若斯特沙利文报告,中国中度至重度干眼病患者人数估计超过 1.17 亿(2019年),SkQ1 产品的潜在市场规模预计将非常可观。
2020年,集团与上海复宏汉霖生物技术股份有限公司(“复宏汉霖”)签订共同开发及独家许可协议,共同开发一款以抗血管内皮生长因子(“抗VEGF”)为活性药物成分,主要用于治疗渗出性(湿性)年龄相关性黄斑变性(“湿性 AMD”)的产品。截至报告日,用于治疗湿性AMD的重组抗VEGF人源化单克隆抗体眼用注射液EB12-20145P(HLX04-O)已获准在澳大利亚、美国、新加坡和欧盟国家(如匈牙利、西班牙和拉脱维亚)开展三期临床试验。 此外,中国首例患者已经完成EB12-20145P(HLX04-O)的一期临床试验给药,用以治疗湿性 AMD。
抗VEGF许可产品可用于治疗湿性AMD、糖尿病性黄斑水肿、视网膜静脉阻塞引起的黄斑水肿及近视性黄斑部病变。根据弗若斯特沙利文报告,中国境内该等4类病患人数于2019年估计超逾1550万人。假设每病患于治疗的首年注射4个剂量并于其后年度注射2至3个剂量,预计抗VEGF许可产品的潜力市场规模巨大。
2021年6月9日,集团与西藏林芝百盛药业有限公司(“百盛”)签订一项产品权益转让协议,内容涉及收购与适丽顺®及其他以卵磷脂络合碘作为活性药物成分的不同剂型药品的全部产品研发技术和生产工艺有关的所有知识产权,收购代价为人民币9,700万元(相当于约1.18亿港元)。此收购事项将进一步加强集团眼科业务。
2021年上半年所获荣誉与奖项
• 集团全资附属公司珠海亿胜生物制药有限公司首度入选“中国化药企业TOP100排行榜”;
• 集团旗下贝复舒®连续三年荣登“2021中国医药·品牌榜”。
市场发展
近年来,集团不断增加投入,以建立和加强市场渠道能力。截至2021年6月30日,集团在中国设有43个销售推广办事处,共有约1,280名市场销售代表。回顾期内,集团产品销售网络已覆盖中国主要省份、城市及县城超过9,760家医院及医疗机构,以及约2,100家药店。
为实现目前已上市产品及近期至中期即将上市新产品的可持续增长,集团在以下几个方面持续投入,以提高竞争力和扩大受众基础:
• 开展多个已上市产品的临床观察计划,以拓展新的临床适应症;
• 开发三四线城市市场;
• 开发药店渠道以作为现有销售渠道的补充;
• 开发医疗科技线上平台,为慢性病患者提供在线问诊服务并开具电子处方。
研发
集团于2020年重申其研发愿景:强调致力于科学和创新,肩负使命开发药物/疗法以解决未被满足的临床和/或商业化需求。集团同时启动了为期5年(2021年 - 2025年)的研发发展计划,旨在进一步加强眼科领域的研发能力和市场地位。
于回顾期内,集团已获得不含防腐剂单剂量盐酸莫西沙星滴眼液在中国获批注册及商业化。
截至2021年6月30日,共有14项研发项目处于临床前至临床阶段,其中3项眼科研发项目分别处于新药临床试验申请(IND)/临床阶段,预计将于中期内驱动集团收入增长,详列如下:
- EB11-18136P: SkQ1滴眼液,三期临床第二阶段试验(VIST-2)顶线数据已于2021年2月24日公布 (美国,FDA)
- EB11-15120P: 阿奇霉素滴眼液,外部专家正在进行审查(中国,NMPA)
- EB12-20145P: 贝伐珠单抗(用于治疗湿性年龄相关性黄斑变性),一期临床试验阶段(全球,美国FDA, 欧洲EMA,澳大利亚ATG以及中国NMPA)
目前,集团已在中国珠海、美国波士顿、英国伦敦和新加坡建立研发中心,这将促进新产品的研发,同时也将有利于吸纳全球的人才。
为答谢各位股东一直以来的支持,董事会已于8月12日决议宣派2021年中期股息每股普通股0.04港元(截至2020年6月30日止六个月:无)。































































 粤公网安备 44049102496184号
粤公网安备 44049102496184号