公司新闻
亿胜生物公布2022年度业绩,兼具业务韧性与市场地位,蓄势增长
2023.03.08
下载查看
香港,2023年3月8日
亿胜生物科技有限公司(“亿胜生物”或“集团”;股份代码:1061.HK)今日公布截至2022年12月31日止的年度财务业绩。
财务表现
于回顾年度,受到新冠疫情的零星出现及持续传播,加上国内对此实施的“清零政策”的影响,公司财务业绩受到负面影响,进行中的临床试验计划亦遭推迟。截至业绩公布之日,医院和门诊运营已逐渐恢复正常。
于截至2022年12月31日止年度,集团实现整体收入约13.18亿港元,净利润约2.25亿港元。本集团的负面利润影响主要来自2021年收购YesDok Pte Ltd及其于印度尼西亚全资附属公司产生的约2500万港元的商誉减值亏损。
截至2022年12月31日,集团的现金及现金等值物约为5.44亿港元(2021年︰约6.71亿港元)。董事会欣然建议派发末期股息每股普通股0.025港元(2021年:0.055港元),惟有待公司应届股东周年大会批准后方可作实。连同于2022年9月21日支付的每股0.04港元的中期股息,2022全年股息总额为每股0.065港元(2021年: 0.095港元)。
眼科及外科分部收入
集团收入主要由眼科及外科(创伤修复)两部分部组成, 其中眼科收入约为5.54亿港元,占集团收入的42.0%;外科收入约为7.64亿港元,占集团收入的58.0%。目前具有增长动力的核心产品为:
1. 眼科-贝复舒®系列(贝复舒®滴眼液、贝复舒®眼用凝胶及贝复舒®单剂量滴眼液)、妥布霉素滴眼液、左氧氟沙星滴眼液、玻璃酸钠滴眼液、盐酸莫西沙星滴眼液及适丽顺®(卵磷脂络合碘胶囊);
2. 外科(创伤护理修复)-贝复济®系列(贝复济®液体制剂、贝复济®冻干粉及贝复新®凝胶)、Carisolv®龋齿凝胶、伢典医生®漱口水及伊血安颗粒。
重大业务进展
集团致力于务实投入新产品及技术以强化集团的产品及研发管线,作为眼科近中期增长动力及肿瘤科新治疗领域的长期计划。在本报告年度所述期间,业务发展活动取得的重要里程碑概述如下:
完成适丽顺®络合碘卵磷脂胶囊的收购,集团再添核心产品
2022年3月8日,收购完成适丽顺®络合碘卵磷脂胶囊的产品研发、生产和上市许可持有人的相关技术和流程知识产权,自此适丽顺®络合碘卵磷脂胶囊成为集团的核心产品之一。
成功从Mitotech获得SkQ1眼科领域全球独家权益
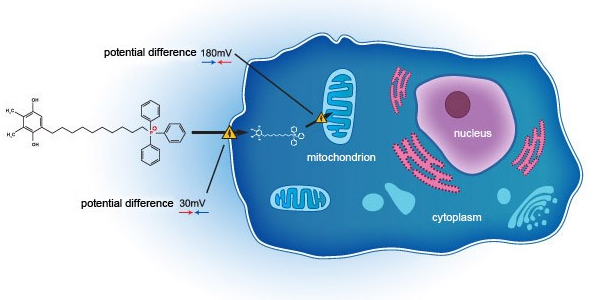
为了使集团于干眼症领域的美国药监局VISTA计划的持续发展更具灵活性及独立性,并使集团能够进一步探索开发其他适应症的眼科产品,以满足全球(定义见下方)市场的临床及商业化需求。2022年10月13日,集团自Mitotech成功获得眼科领域与SkQ1相关的i)专利及专有技术许可协议;及ii)专利转让契据。
根据专利转让契据,Mitotech同意向集团转让在眼科及所有眼科适应症领域与SKQ1相关的发明及专利的所有权利。
根据专利及专有技术许可协议,Mitotech同意授予集团独家、可转让及不可撤销的全球(不包括亚美尼亚、白俄罗斯、哈萨克斯坦斯坦斯坦、吉尔吉斯斯坦及俄罗斯)许可,以使用Mitotech拥有的与SkQ1相关的专利,开发、制造、销售及供应用于眼睛及其附属器官的任何治疗产品或疗法,申请及获得临床试验的全球监管批准,并获得与产品相关的市场推广授权。
继2022年10月收购与SkQ1相关的知识产权后,本集团的首要任务为完成SkQ1的化学成分生产与控制(CMC)、专有技术及知识产权的转让。同时,本集团正在与监管机构重新建立VISTA计划,以在继续进行临床试验前减轻任何可识别的风险。根据弗若斯特沙利文的资料,2020年中国境内仅中度至重度干眼症患者人数逾1.2亿。SkQ1产品的潜在市场规模巨大。
EB12-20145P (HLX04-O)全球三期临床研究取得重大进展
2020年,集团与上海复宏汉霖生物技术股份有限公司订立共同开发及独家许可协议,共同开发一种用于治疗渗出性(湿性)年龄相关性黄斑变性(“湿性AMD”)的重组抗血管内皮生长因子(“抗VEGF”)人源化单克隆抗体注射液EB12-20145P。于回顾期内,该产品已获批准在澳大利亚、美国、新加坡、俄罗斯、塞尔维亚以及匈牙利、西班牙、拉脱维亚、捷克共和国及波兰等欧盟国家开展三期临床试验。此外,用以治疗湿性AMD的EB12-20145P三期临床研究已于中国、拉脱维亚、澳大利亚及美国的完成首例患者给药。
2023年2月,本集团与复宏汉霖订立一份经修订协议,以修订共同开发许可协议的若干条款,其中包括支付监管及商业销售里程碑的付款以及开发成本。详细信息已于2023年2月22日的公司公告和2023年3月8日的公司年度业绩公告中公布。
抗VEGF许可产品可用于治疗湿性AMD、糖尿病黄斑水肿、视网膜静脉阻塞引起的黄斑水肿和近视性脉络膜新生血管。根据弗若斯特沙利文的资料,中国境内该等4类病患人数于2020年估计超逾1580万人。假设每病患于治疗的首年注射4个剂量并于其后年度注射2至3个剂量,抗VEGF许可产品的潜在市场规模巨大。
2022年获得的荣誉及奖项
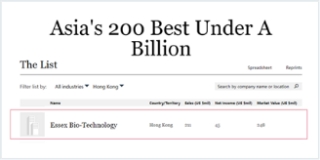
集团荣登2022年福布斯亚洲中小上市企业榜,此乃对集团时至今日成就的肯定。福布斯亚洲中小上市企业榜遴选200家年度销售额低于10亿美元的亚太地区最佳中小上市企业。此外,集团还荣获中国卓越IR -最佳股东关系奖及最佳ESG奖。同时,集团全资附属公司珠海亿胜生物制药有限公司荣登2021年度珠海市医药健康制造业十强企业,同时亦荣登2021年度TOP100中国化药企业。集团旗下贝复舒®已连续四年荣登中国医药 • 品牌榜,证明业界对集团旗舰生物药的疗效及质量的认可。
市场开发巩固市场渠道能力
数年来,集团一直不懈投入资源积蓄及强化其市场渠道能力。截至2022年12月31日,集团于中国设有43间销售推广办事处,共有约1,240销售代表, 覆蓋中国主要省份、城市以及县城逾10,900家医院及医疗机构以及约2,130家药房。在渠道下沉,开发多线城市市场的同时,通过在线医疗咨询和电子处方平台,为慢性病患者提供更多服务。
自2020年以来,集团通过新加坡基地向东南亚国家扩大市场准入,取得了良好的发展势头。
研究与开发
在本公告所述期间,集团将继续专注于执行其5年(2021年至2025年)研发发展计划。截至报告日期,共有16项研发计划处于临床前至临床阶段,其中下列4项眼科计划(包含2022年新增的EB11-21148P)处于后期临床阶段。为中期增长动力项目:
亿胜生物科技有限公司(“亿胜生物”或“集团”;股份代码:1061.HK)今日公布截至2022年12月31日止的年度财务业绩。
财务表现
于回顾年度,受到新冠疫情的零星出现及持续传播,加上国内对此实施的“清零政策”的影响,公司财务业绩受到负面影响,进行中的临床试验计划亦遭推迟。截至业绩公布之日,医院和门诊运营已逐渐恢复正常。
于截至2022年12月31日止年度,集团实现整体收入约13.18亿港元,净利润约2.25亿港元。本集团的负面利润影响主要来自2021年收购YesDok Pte Ltd及其于印度尼西亚全资附属公司产生的约2500万港元的商誉减值亏损。
截至2022年12月31日,集团的现金及现金等值物约为5.44亿港元(2021年︰约6.71亿港元)。董事会欣然建议派发末期股息每股普通股0.025港元(2021年:0.055港元),惟有待公司应届股东周年大会批准后方可作实。连同于2022年9月21日支付的每股0.04港元的中期股息,2022全年股息总额为每股0.065港元(2021年: 0.095港元)。
眼科及外科分部收入
集团收入主要由眼科及外科(创伤修复)两部分部组成, 其中眼科收入约为5.54亿港元,占集团收入的42.0%;外科收入约为7.64亿港元,占集团收入的58.0%。目前具有增长动力的核心产品为:
1. 眼科-贝复舒®系列(贝复舒®滴眼液、贝复舒®眼用凝胶及贝复舒®单剂量滴眼液)、妥布霉素滴眼液、左氧氟沙星滴眼液、玻璃酸钠滴眼液、盐酸莫西沙星滴眼液及适丽顺®(卵磷脂络合碘胶囊);
2. 外科(创伤护理修复)-贝复济®系列(贝复济®液体制剂、贝复济®冻干粉及贝复新®凝胶)、Carisolv®龋齿凝胶、伢典医生®漱口水及伊血安颗粒。
重大业务进展
集团致力于务实投入新产品及技术以强化集团的产品及研发管线,作为眼科近中期增长动力及肿瘤科新治疗领域的长期计划。在本报告年度所述期间,业务发展活动取得的重要里程碑概述如下:
完成适丽顺®络合碘卵磷脂胶囊的收购,集团再添核心产品
2022年3月8日,收购完成适丽顺®络合碘卵磷脂胶囊的产品研发、生产和上市许可持有人的相关技术和流程知识产权,自此适丽顺®络合碘卵磷脂胶囊成为集团的核心产品之一。
成功从Mitotech获得SkQ1眼科领域全球独家权益
为了使集团于干眼症领域的美国药监局VISTA计划的持续发展更具灵活性及独立性,并使集团能够进一步探索开发其他适应症的眼科产品,以满足全球(定义见下方)市场的临床及商业化需求。2022年10月13日,集团自Mitotech成功获得眼科领域与SkQ1相关的i)专利及专有技术许可协议;及ii)专利转让契据。
根据专利转让契据,Mitotech同意向集团转让在眼科及所有眼科适应症领域与SKQ1相关的发明及专利的所有权利。
根据专利及专有技术许可协议,Mitotech同意授予集团独家、可转让及不可撤销的全球(不包括亚美尼亚、白俄罗斯、哈萨克斯坦斯坦斯坦、吉尔吉斯斯坦及俄罗斯)许可,以使用Mitotech拥有的与SkQ1相关的专利,开发、制造、销售及供应用于眼睛及其附属器官的任何治疗产品或疗法,申请及获得临床试验的全球监管批准,并获得与产品相关的市场推广授权。
继2022年10月收购与SkQ1相关的知识产权后,本集团的首要任务为完成SkQ1的化学成分生产与控制(CMC)、专有技术及知识产权的转让。同时,本集团正在与监管机构重新建立VISTA计划,以在继续进行临床试验前减轻任何可识别的风险。根据弗若斯特沙利文的资料,2020年中国境内仅中度至重度干眼症患者人数逾1.2亿。SkQ1产品的潜在市场规模巨大。
EB12-20145P (HLX04-O)全球三期临床研究取得重大进展
2020年,集团与上海复宏汉霖生物技术股份有限公司订立共同开发及独家许可协议,共同开发一种用于治疗渗出性(湿性)年龄相关性黄斑变性(“湿性AMD”)的重组抗血管内皮生长因子(“抗VEGF”)人源化单克隆抗体注射液EB12-20145P。于回顾期内,该产品已获批准在澳大利亚、美国、新加坡、俄罗斯、塞尔维亚以及匈牙利、西班牙、拉脱维亚、捷克共和国及波兰等欧盟国家开展三期临床试验。此外,用以治疗湿性AMD的EB12-20145P三期临床研究已于中国、拉脱维亚、澳大利亚及美国的完成首例患者给药。
2023年2月,本集团与复宏汉霖订立一份经修订协议,以修订共同开发许可协议的若干条款,其中包括支付监管及商业销售里程碑的付款以及开发成本。详细信息已于2023年2月22日的公司公告和2023年3月8日的公司年度业绩公告中公布。
抗VEGF许可产品可用于治疗湿性AMD、糖尿病黄斑水肿、视网膜静脉阻塞引起的黄斑水肿和近视性脉络膜新生血管。根据弗若斯特沙利文的资料,中国境内该等4类病患人数于2020年估计超逾1580万人。假设每病患于治疗的首年注射4个剂量并于其后年度注射2至3个剂量,抗VEGF许可产品的潜在市场规模巨大。
2022年获得的荣誉及奖项
集团荣登2022年福布斯亚洲中小上市企业榜,此乃对集团时至今日成就的肯定。福布斯亚洲中小上市企业榜遴选200家年度销售额低于10亿美元的亚太地区最佳中小上市企业。此外,集团还荣获中国卓越IR -最佳股东关系奖及最佳ESG奖。同时,集团全资附属公司珠海亿胜生物制药有限公司荣登2021年度珠海市医药健康制造业十强企业,同时亦荣登2021年度TOP100中国化药企业。集团旗下贝复舒®已连续四年荣登中国医药 • 品牌榜,证明业界对集团旗舰生物药的疗效及质量的认可。
市场开发巩固市场渠道能力
数年来,集团一直不懈投入资源积蓄及强化其市场渠道能力。截至2022年12月31日,集团于中国设有43间销售推广办事处,共有约1,240销售代表, 覆蓋中国主要省份、城市以及县城逾10,900家医院及医疗机构以及约2,130家药房。在渠道下沉,开发多线城市市场的同时,通过在线医疗咨询和电子处方平台,为慢性病患者提供更多服务。
自2020年以来,集团通过新加坡基地向东南亚国家扩大市场准入,取得了良好的发展势头。
研究与开发
在本公告所述期间,集团将继续专注于执行其5年(2021年至2025年)研发发展计划。截至报告日期,共有16项研发计划处于临床前至临床阶段,其中下列4项眼科计划(包含2022年新增的EB11-21148P)处于后期临床阶段。为中期增长动力项目:
- EB11-18136P:SkQ1滴眼液,三期临床第二阶段试验 (VISTA-2)顶线数据已于2021年2月24日发布(美国药监局)
- EB11-15120P:阿奇霉素滴眼液,外部专家正在审查(中国国家药品监督管理局)
- EB12-20145P:贝伐珠单抗(用于治疗湿性年龄相关性黄斑变性),三期临床试验(美国药监局、欧洲药品管理局、澳大利亚药物管理局及中国国家药品监督管理局)
- EB11-21148P:环孢素滴眼液,二期临床试验(中国国家药品监督管理局)
集团持有69份专利证书或授权书,包括50项发明专利、14项实用新型专利及5项外观专利。同时,本集团目前已将其研发资源多元化至珠海(中国)、波士顿(美国)、伦敦(英国)及新加坡的多个研究基地,这既能支持集团对新疗法的追求,也能支持我们对全球人才的获取。
亿胜生物主席严名炽先生表示﹕“尽管COVID-19疫情给我们所有人带来又一个艰难的年度,但我们基因中的韧性、动力及领导力能够为股东带来持续价值。除去不可预测的情况外,集团将基于优异的发展韧性与优势的市场地位,蓄势增长,对取得持续成果持乐观态度。
谨借此机会向集团所有股东、业务伙伴及客户致以衷心谢意,感谢各位对集团的信任、支持及与我们衷诚合作,并感谢每一位成员作出的不懈努力,致力将公司打造为一家锐意进取且前途光明的制药企业。”
- 完 –
关于亿胜生物 (股票代码﹕1061.HK)
亿胜生物科技有限公司是一间专注于研发,生产和销售基因工程药物b-bFGF(FGF-2)的生物制药企业,自1998年起已有六种基因工程药物在中国上市销售。此外,公司还拥有一系列不含防腐剂单剂量滴眼液和适丽顺®(卵磷脂络合碘胶囊)等产品。公司产品主要应用于眼科及皮肤科处方药领域的创伤修复及疾病治疗,目前凭借在中国主要城市的43个销售推广办事处已成功覆蓋中国逾10,900家医院。公司依托自身在生长因子和抗体领域的研发平台,拥有多个临床阶段的项目,涵盖广泛的领域和适应症。































































 粤公网安备 44049102496184号
粤公网安备 44049102496184号